“软黄金”如何从实验室走向市场的?
在农业领域,通过改造代谢途径、遗传回路或者生物体结构,研究人员可以提高农作物的产量。同时,可持续农业是合成生物学应用的另一方向,例如通过改造微生物来进行生物施肥或者生物控制等。公元前 3000 年 - 19 世纪 胶原蛋白的发现与使用
在古埃及和古希腊时期,人们利用兽皮和兽骨等富含胶原蛋白的材料来达到医疗和美容的目的。西汉时期,我国现存最早的医方著作《五十二病方》中也有记载“以皮制胶,涂之以创,愈之”。19 世纪 胶原蛋白分子水平的认识
人们对胶原蛋白分子水平的认识始于 19 世纪。1844 年,法国化学家蒙特古(Maurice Raynaud)首次将胶原蛋白命名为 "Collagen"。20 世纪初-中期 胶原蛋白结构与功能的研究
20 世纪初,科学家乔尔·莱布(Jo?l Le Magnen)提出了胶原蛋白的三股螺旋结构假设,为后来的研究奠定了基础。20 世纪中期,哈佛大学发现胶原蛋白溶液加热到人体正常体温时转变为凝胶。随着合成生物技术的发展,科学家们进一步研究不同类型的胶原蛋白在组织中的分布和功能。20 世纪末至今 胶原蛋白市场化应用
胶原蛋白研究的突破始于 20 世纪 80 年代,1981 年,历史上第一款动物胶原蛋白产品——牛源胶原蛋白产品 Zyderm 正式被 FDA 获批,在欧美掀起一阵注射胶原蛋白美容的风潮。但由于动物源存在疾病感染风险,研究人员将焦点聚集到利用基因工程生产重组胶原蛋白的方向上。1997 年,Vuorela 等人成功利用毕赤酵母表达了人Ⅰ,Ⅱ,Ⅲ型胶原蛋白全序列。2002 年,西北大学范代娣等人采用PCR技术获得人胶原蛋白基因片段,通过高密度发酵方式培养生产类人胶原蛋白。2009 年,Werten 等利用基因工程制备了具有生物活性的人源性明胶,经纯化后替代动物来源的胶原蛋白用作疫苗稳定剂。2010 年,范代娣课题组成功利用大肠杆菌基因工程菌 BL21(DE) 发酵生产并分离纯化了类人胶原蛋白,改进了动物体胶原蛋白的水溶性、免疫排异性、吸收性等特性,并通过和西安巨子生物合作进行规模化生产。目前,以胶原蛋白为基础的产品在医美和保健行业比较流行,包括抗衰护肤、伤口愈合、美容手术等。基因工程重组胶原蛋白
基因工程重组胶原蛋白是将人体胶原蛋白基因进行特定序列设计、酶切和拼接、连接载体后转入宿主细胞内,包括微生物、动物和植物等,再进行发酵诱导表达生产的胶原蛋白或类似物的技术。重组胶原蛋白的生产过程主要包括表达体系的构建、发酵和纯化。由于动、植物细胞的培养难度大,成本高,不适合大规模生产,采用大肠杆菌、酵母等微生物作为宿主是较为理想的选择,也逐渐成为重组胶原蛋白工业化的趋势。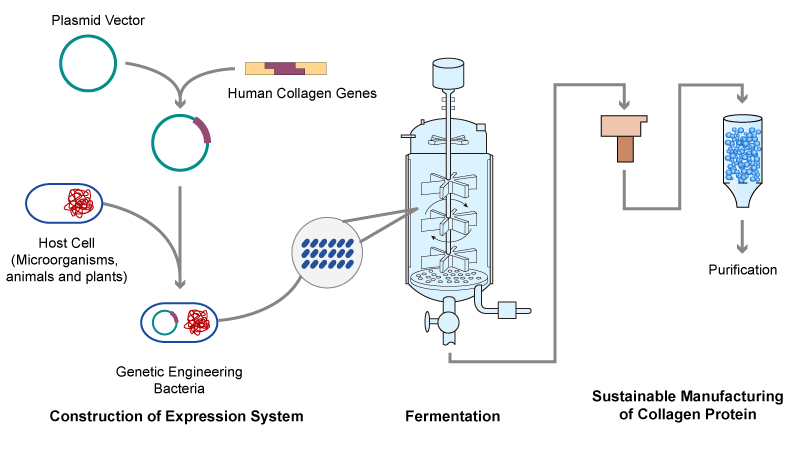 重组胶原蛋白绿色制造
重组胶原蛋白绿色制造在 2021 年 3 月 15 日国家药监局发布的《重组胶原蛋白生物材料命名指导原则》中,将重组胶原蛋白主要分为三类:重组人胶原蛋白、重组人源化胶原蛋白以及重组类胶原蛋白。
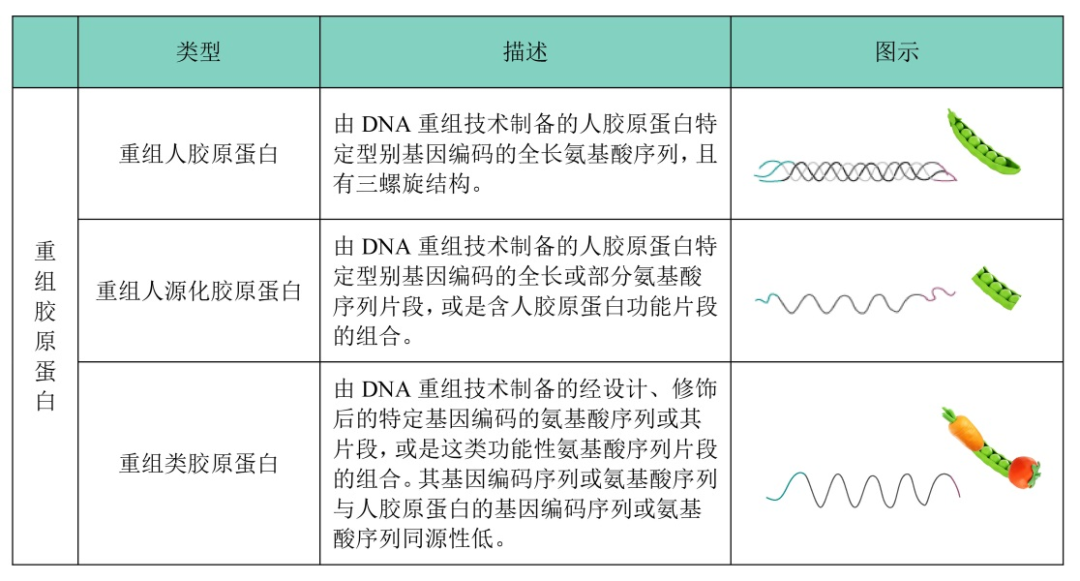
基因工程重组胶原蛋白技术难点
胶原蛋白以胶原纤维的形式存在。其基本结构单位是原胶原分子,长度约 300nm,分子量约为 300kDa。每个原胶原都有一种特殊的三重螺旋结构,由 3 条 α- 螺旋的肽链缠绕而成;三螺旋区段最大特征是氨基酸呈 (Gly-X-Y)n 周期性排列,每条 α 链大约含有 300 个左右 (Gly-X-Y) 的重复结构。X、Y 位置可以是任何氨基酸,多为脯氨酸和羟脯氨酸。在三螺旋构象稳定过程中羟脯氨酸羟基能形成强氢键,可提高胶原蛋白强度;脯氨酸和羟脯氨酸能使胶原三螺旋结构发生急剧扭曲,提高胶原蛋白的稳定性。研究发现,亚氨基酸(脯氨酸和羟脯氨酸)的含量越高,胶原蛋白三螺旋结构相对越稳定。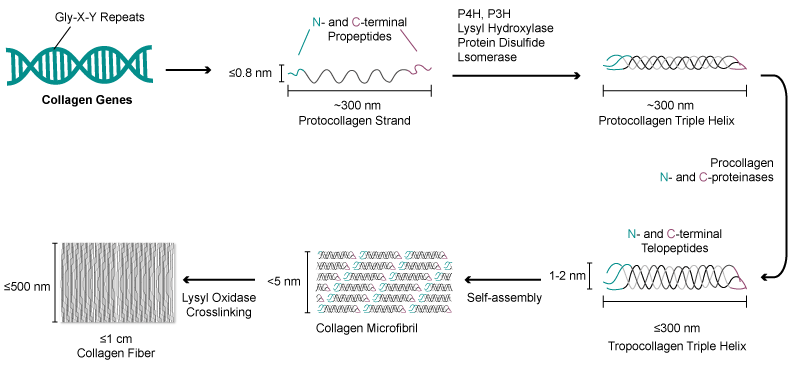 胶原蛋白纤维结构
胶原蛋白纤维结构三螺旋胶原蛋白分子组装成超分子结构的能力是胶原蛋白在医疗应用(如美容手术和组织修复)中商业用途的基础。破坏胶原蛋白三重螺旋的稳定性会阻碍其自组装,或削弱富含胶原蛋白的结构,这表明正确的氨基酸序列对胶原蛋白的正常功能至关重要。因此,在制备具有特定胶原蛋白序列的三螺旋多肽时,主要的技术难点在于基因片段的选择及三螺旋结构的稳定性。于此同时,在细胞发酵、蛋白纯化等环节,工业化制备的重组胶原蛋白的产量、及纯度仍有很大的提升空间。
重组胶原蛋白产量优化从基因源头开始
泓迅科技拥有先进的合成生物赋能技术平台。自主研发 Complex Index(CI)、NGCodonTM、AI-TAT、DNA StudioTM 等多款生物智能分析工具,与自有专利试剂 Syno Interlinkage 、Syno Assembly 相结合,推动基因合成向着更加智能化、精准化和快速化方向发展。我们在重组胶原蛋白基因合成上拥有丰富经验,超前设计、先进制造与核心工具相结合,精准合成重组胶原蛋白“高”重复基因。定制化基因合成设计方案、优质的大肠杆菌工程菌株库与完整的分子克隆工具酶体系,帮您解决源头基因合成难点!协助您在实验室中以极低的成本尝试大量的基因设计,提高胶原蛋白的表达量、亲水性和可加工性,创造更多应用可能。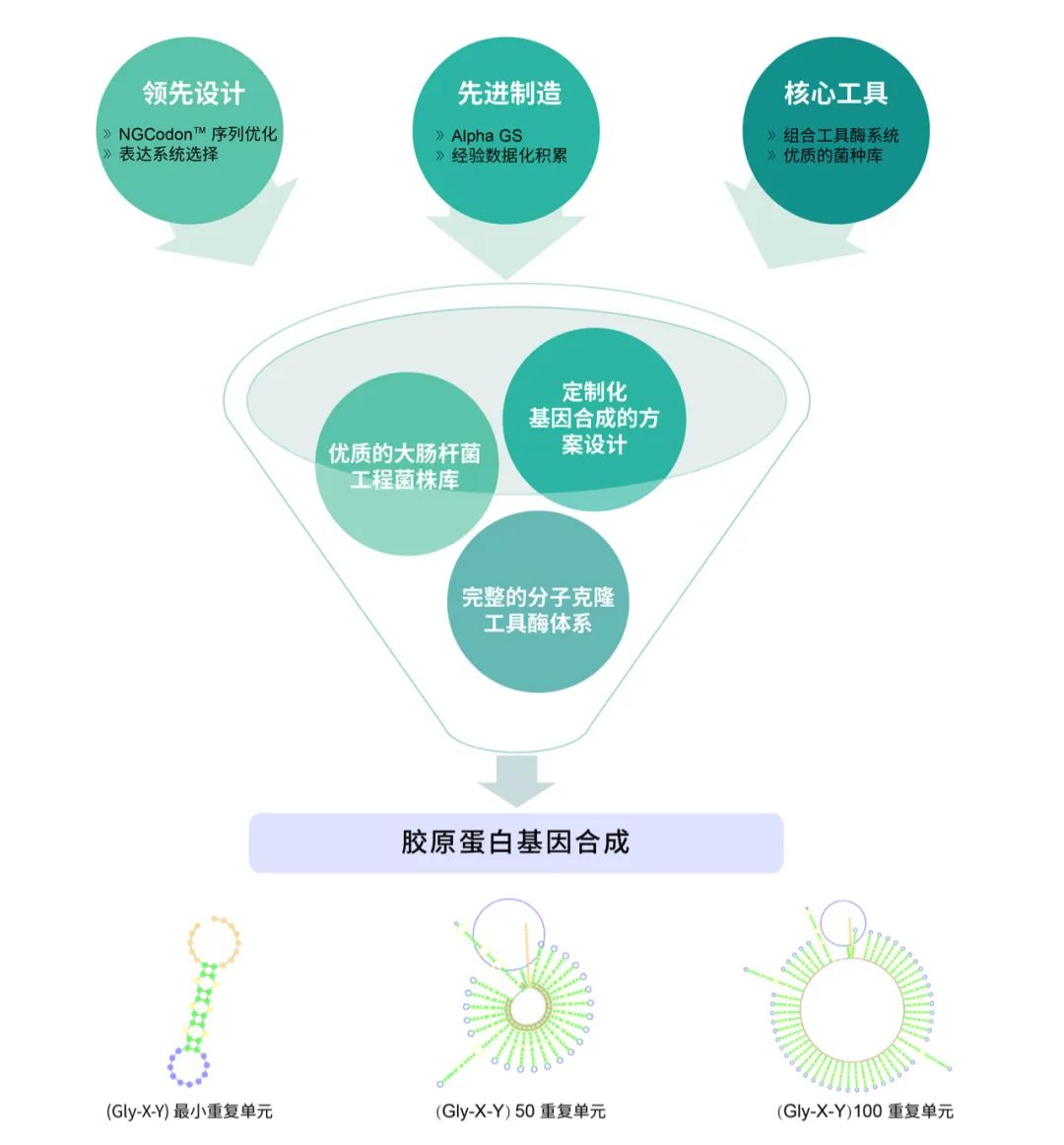 定制化胶原蛋白基因合成方案
定制化胶原蛋白基因合成方案
未/来/展/望
重组胶原蛋白正在经历着从 “日常护肤” ,到“医疗美容”,到“医疗器械”,再到“生命科学”应用的路径演变。实现胶原蛋白的定量表达、功能定向强化以及规模化生产优化不是一蹴而就的事情。人工智能也在推动生物研究的前沿发展,帮助科学家对胶原蛋白进行“编程”,就像软件工程师编写“代码”一样!未来,以“基因调控,工程设计”为核心,从胶原蛋白分子的定向设计、细胞工厂构建与适配调控等方面出发,并通过设计、构建和测试优化逐步突破自然进化的限制。在人工设计指导下,实现胶原蛋白从 “日常护肤” 到 “生命科学”的跨越值得期待!Reference:[1] 何会霞. 重组胶原蛋白及其生物材料的制备和性质研究[D].兰州大学,2023.DOI:10.27204/d.cnki.glzhu.2023.000164.[2] 魏春,刘春,刘心雨等.基因工程技术生产重组胶原蛋白的 研究进展[J].发酵科技通讯,2021,50(01):1-5.DOI:10.16774/j.cnki.issn.1674-2214.2021.01.001.[3] 李阳,朱晨辉,范代娣.重组胶原蛋白的绿色生物制造及其应用[J].化工进展,2021,40(03):1262-1275.DOI:10.16085/j.issn.1000-6613.2020-2109.[4] Fertala A. Three Decades of Research on Recombinant Collagens: Reinventing the Wheel or Developing New Biomedical Products? Bioengineering (Basel). 2020 Dec 2;7(4):155. doi: 10.3390/bioengineering7040155.[5] Sorushanova A, Delgado LM, Wu Z, Shologu N, Kshirsagar A, Raghunath R, Mullen AM, Bayon Y, Pandit A, Raghunath M, Zeugolis DI. The Collagen Suprafamily: From Biosynthesis to Advanced Biomaterial Development. Adv Mater. 2019 Jan;31(1):e1801651. doi: 10.1002/adma.201801651.[6] Koide T. Designed triple-helical peptides as tools for collagen biochemistry and matrix engineering. Philos Trans R Soc Lond B Biol Sci. 2007 Aug 29;362(1484):1281-91. doi: 10.1098/rstb.2007.2115.[7] 范代娣,段明瑞,米钰等.重组E.coli工程菌高密度培养生产人源型胶原蛋白[J].化工学报,2002(07):752-754.本文地址:http://www.chinaxhk.net/jiankang/50746.html - 转载请保留原文链接。| 免责声明:本文转载上述内容出于传递更多信息之目的,不代表本网的观点和立场,故本网对其真实性不负责,也不构成任何其他建议;本网站图片,文字之类版权申明,因为网站可以由注册用户自行上传图片或文字,本网站无法鉴别所上传图片或文字的知识版权,如果侵犯,请及时通知我们,本网站将在第一时间及时删除。 |